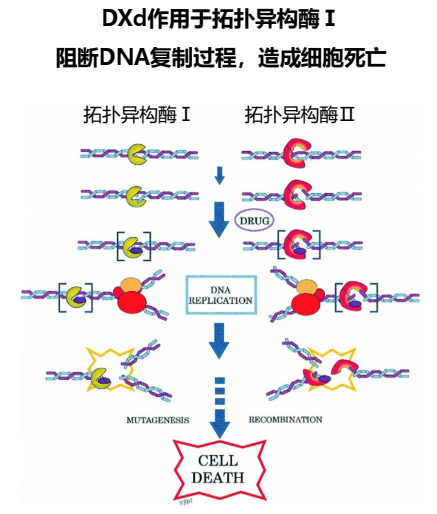
既往传统化疗模式,因为无法精准将化疗药物运载至肿瘤细胞,存在治疗窗较窄的问题,抗体药物偶联物(ADC)通过靶向+化疗联合的方式,有效扩大治疗窗,打破了传统细胞毒药物的限制。 ADC精准、强效抗肿瘤,突破化疗困境 自19世纪40年代,氮芥和叶酸拮抗剂首先应用于血液系统恶性肿瘤,在随后的70余年中,化疗药物不断丰富,成为肿瘤领域较为重要的治疗手段之一。但是传统化疗在杀死肿瘤细胞的同时,也对正常细胞存在杀伤作用,从而产生严重的毒副作用。因此,如何将细胞毒药物精确输送到病灶部位,选择性地杀伤肿瘤细胞,以扩大治疗窗成为抗肿瘤药物的主要发展方向。追溯到100年前,Paul Ehrlich 就提出了利用抗体靶向作用治疗癌症的“魔术子弹”概念。得益于抗体技术的快速发展,掀起了ADC药物的研究浪潮[1,2]。 图1. 靶向治疗相比化疗能扩展治疗指数 ADC由单克隆抗体和小分子细胞毒药物通过连接子偶联而成,利用单克隆抗体的靶向性,特异性识别肿瘤细胞表面的抗原,在抗体介导的内吞作用下进入肿瘤细胞内部,再经溶酶体降解释放细胞毒素,杀死肿瘤细胞,以达到提高药效,降低毒性,从而增大治疗窗的目的[3]。既往已经探讨过ADC药物的连接子和药物抗体比(DAR),本次将继续探讨ADC药物的载药。 ADC有效载荷的分类和特点 广义而言,ADC有效载荷可以是小分子细胞毒素、蛋白质毒素、蛋白质、酶和放射性核素[4]。其中,小分子细胞毒素占目前ADC有效载荷开发的大部分。天然或合成的细胞毒素有无数种,但只有少数被发现适用于ADC药物。为了触发细胞毒作用,有效载荷应具有以下复杂特性: ①理想靶点应位于细胞内。 ②一般要求 EC50小于1 nmol/L。研究表明放射标记的抗体在癌症病人肿瘤部位摄取量很低(每克肿瘤组织仅仅集中0.003%-0.01%的抗体注射剂量)[5],因此,有效载荷需在较低浓度下也可发挥作用。 ③可以被修饰,易于结合。天然发现的细胞毒药物往往没有可以连接的位点,大多数需经过结构改造,使之成为具有可连接的基团且与天然结构生物活性相当的衍生物。 ④分子结构必须很小,以降低免疫原性的风险。 ⑤ADC是在水溶液中制备并静脉给药,用于有效载荷的毒素必须可溶且稳定[1,4,6]。 根据作用方式,临床试验中细胞毒素类有效载荷分为三类:微管蛋白抑制剂、DNA损伤剂和转录抑制剂[4]。靶向微管蛋白的毒素主要包括奥瑞他汀类(auristatins)和美登素类(maytansinoids),通过破坏微管功能,阻断细胞有丝分裂,导致不同作用机制的活性分裂细胞死亡。奥瑞他汀类化合物如MMAE和MMAF,brentuximab vedotin是应用MMAE作为有效载荷的首个奥瑞他汀类ADC,已被FDA批准上市用于治疗恶性霍奇金淋巴瘤和间变性大细胞淋巴瘤,揭开了该类 ADC 研发的热潮。但MMAE结构中的氨基酸普遍具有较强的疏水性,使得该类ADC因水溶性差而在血浆中极易发生聚合和沉淀,尽管MMAF结构中包含亲水性较强的羧基,能降低发生聚合的概率,但其透膜能力较差,体外细胞活性较MMAE 显著降低[6,7]。美登素类细胞毒素以DM1和DM4应用较多,具有与美登素相当或更高的活性,对肿瘤细胞的杀伤作用显著优于长春花碱。以DM1作为有效载荷的首个美登素类ADC药物T-DM1已于2013年2月,被FDA批准用于曲妥珠单抗与多西他赛联合用药无效的转移性乳腺癌。但DM1本身具有一定疏水性,当多个载药同时偶联到抗体分子上时,得到的产物会因疏水性增强而导致聚合或沉淀,这也限制了T-DM1的抗体载药比(DAR)只能在较低水平(3.5)。而有研究表明,DAR为5.9的美登素类ADC药物,其药效强度相比 DAR为3.4 时可提高>100 倍,这一点对于治疗靶细胞表面抗原表达相对较少的肿瘤具有十分重要的意义[8,9]。 图2. 奥瑞他汀类和美登素类有效载荷的作用机制 DNA损伤剂包括卡奇霉素类(calicheamicin)、CC-1065类似物,多卡霉素等,由于其强大的细胞毒性,已被广泛用于ADC药物有效载荷的开发。它们通过与DNA小沟结合并诱导双自由基或与作为DNA烷基化剂的腺嘌呤残基反应而发挥作用,从而导致双链DNA裂解和细胞死亡。与靶向微管蛋白聚合的毒素相比,此类细胞毒素可以在其生命周期的任何阶段杀死靶细胞[4]。以卡奇霉素衍生物作为有效载荷的gemtuzumab ozogamicin是FDA首个批准的ADC药物,治疗急性髓系白血病效果显著,但因连接子不稳定毒性较大,曾于2010 年撤市[6]。 图3. 部分DNA损伤剂的作用机制 在DNA损伤剂中还有一类比较值得关注的是喜树碱(Camptothecin,CPT)类,不同于其他DNA损伤剂,CPT通过作用于DNA 拓扑异构酶 ? 抑制DNA的复制和转录,导致肿瘤细胞死亡。CPT具有较强体外抗肿瘤活性,但水溶性差,生物利用度低,临床应用有限。而CPT类衍生物伊立替康(CPT-11)的活性代谢产物7-乙基-10-羟基喜树碱(SN-38)因生物利用度高、抗肿瘤活性强,在ADC药物中得到广泛应用,如Sacituzumab govitecan和Labetuzumab govitecan均采用SN-38作为有效载荷[6]。更值得一提的是,Exatecan甲磺酸盐(DXd/Dx-8951f)与其他CPT类衍生物相比,具有更强的拓扑异构酶?抑制活性和抗肿瘤活性[10],目前已成功用于新一代ADC药物T-DXd、Dato-DXd等的开发。 图4. DXd的作用机制 在ADC开发中,转录抑制剂的主要成分是鹅膏菌毒素(amatoxins),可以与真核细胞的 RNA 聚合酶 II 结合,对哺乳动物酶的亲和力最高。迄今为止,α-鹅膏菌素是针对 RNA 聚合酶 II最有效的特异性抑制剂,可导致细胞凋亡。将鹅膏菌毒素研制成ADC药物“弹头”具有以下特点:首先,在水性介质中具有高溶解度以促进偶联反应;其次,鹅膏菌毒素类ADC药物引起聚集的可能性较小;第三,副作用较少并且能被快速从尿液中排出。基于这些优势,鹅膏菌毒素成为一种极具前景的ADC有效载荷[4]。 图5. RNA聚合酶II转录起始机制模型 T-DXd独特的高活性载药及作用机制 T-DXd是新一代ADC药物的突出代表,其载药DXd属于CPT的水溶性非前体药物类似物,CPT衍生物含有A、B、C、D、E五个环。AB为喹啉环,C为吡咯环,D为吡啶环,E为α-羟基内酯环,五个环位于同一平面。生理条件下,CTP的内酯环部分达到开环形式和内酯形式的平衡。因为人血清白蛋白(HSA)优先与开环形式的CPT结合,导致水解向开环形式移动,CPT内酯形式(活性形式)则减少,抗肿瘤活性降低。并且,开环羧酸盐形式的增加显著加强了毒性,使其无法用于临床。经构效关系研究发现,用羟基取代C-10可增强CPT的抗肿瘤活性,C-7和C-10的双取代可稳定内酯环,从而提高分子的生物活性。因此,合成了CPT-11。肝脏中的羧酸酯酶裂解CPT-11中的酯键,暴露C-10的羟基,能将药物转化为SN-38,并且SN-38的体外活性是CPT-11的100倍。最后在SN-38的基础上,在C-7和C-9处环化,得到DX-8951f(也称为DXd)以进一步增加抑制拓扑异构酶Ⅰ的活性[11]。 图6. DXd/Dx-8951f的合成设计 DXd对32种恶性肿瘤细胞系均有较强的体外抑制活性,具有广谱抗癌作用[11,12]。DXd与乳腺癌常见化疗药物机制不同,能避免交叉耐药,对药物泵p-糖蛋白(P-gp)高表达的肿瘤(常见化疗耐药机制之一),DXd仍然有效[1,12]。目前T-DM1耐药机制尚不明确,但提出了几种可能的耐药机制,包括HER2低表达、细胞内T-DM1有效载荷浓度变化、药物外分泌蛋白表达的变化以及对有效载荷毒性的抵抗等。而T-DXd由高度稳定的连接子将强效拓扑异构酶Ⅰ抑制剂与抗体偶联,与T-DM1(DAR为3.5)相比,能带来更高的DAR值(8)。提示通过增加靶细胞中细胞毒性有效载荷的浓度,T-DXd可能避免T-DM1中观察到的耐药性[11]。 图7. 部分ADC有效载荷及常用化疗药物的作用机制 DXd的抗肿瘤活性约为SN-38的10倍,是常见化疗药物的100-1000倍,可有效降低给药剂量[10,12]。在安全性方面,动物试验显示注射T-DXd后,游离DXd浓度极低,且代谢迅速,保证其高活性下的安全性。并且,研究表明体内SN-38的失活由尿苷二磷酸葡萄糖醛酸转移酶(UGT)1A1介导。UGT1A1基因功能异常可能导致一些患者发生重度CPT不良事件。因此,SN-38及其前药伊立替康的应用受到UGT1A1基因多态性的限制。而T-DXd不通过UGT1A1代谢,因此理论上比CPT更安全[11]。 图8. DXd的抗肿瘤活性 此外,DXd被释放后末端自切割形成羟基,生理pH条件下增加亲水性,但不带电荷,容易透过细胞膜。得益于DXd良好的细胞膜渗透性,能够进入周围细胞,发挥抗肿瘤作用,即所谓的“旁观者效应”。而T-DM1在抗体裂解后,释放的活性产物为赖氨酸、连接子和DM1形成的化合物,携带电荷且极性强,不易穿过细胞膜,因而不存在“旁观者效应”。并且,DXd系统半衰期短,T-DXd的旁观者效应仅杀伤旁邻肿瘤细胞对远处细胞无影响,杀伤肿瘤的同时,能确保系统安全性[13]。 图9. T-DXd自我脱氨化设计,增加旁观者效应 总结 T-DXd具有高活性细胞毒载药,游离状态下DXd的系统半衰期短,能有效降低非靶点毒性,安全性可控。并且与常见ADC有效载荷和化疗药物作用机制不同,能避免继发性耐药。此外,具有良好的细胞膜渗透性,能发挥旁观者效应,这将转化为针对HER2低表达患者的强效抗肿瘤活性。 专家介绍 樊英 教授 中国医学科学院肿瘤医院内科主任医师 硕导 协和医科大学八年制 博士 2008-2009年英国Royal Marsden医院/ICR访问学者 中国医药教育协会临床科研创新发展专业委员会副主任委员 秘书长 中国抗癌协会肿瘤药物临床研究专业委员会青委会副主委 北京乳腺病防治学会青年专委会副主任委员 中华肿瘤健康管理学院秘书长 中国抗癌协会肿瘤化疗专业委员会委员 CSCO青年专业委员会委员 《临床肿瘤学杂志》编委等 天津市医学会肿瘤分会副主任委员 参考文献: [1]Chau CH, Steeg PS, Figg WD. Antibody-drug conjugates for cancer. Lancet. 2019 Aug 31;394(10200):793-804. [2]Strebhardt K, Ullrich A. Paul Ehrlich's magic bullet concept: 100 years of progress. Nat Rev Cancer, 2008, 8(6):473-480. [3]Yaghoubi S, Karimi MH, Lotfinia M, et al. Potential drugs used in the antibody-drug conjugate (ADC) architecture for cancer therapy. J Cell Physiol. 2020 Jan;235(1):31-64. [4] https://www.creativebiolabs.net/amatoxins.htm [5] Sedlacek HH, Seemann G, HoffmannD, et al. Antibodies as carriers of cytotoxicity. Contrib Oncol Basel Karger, 1992, 43:1-45. [6]胡馨月, 李艳萍, 李卓荣. 抗体药物偶联物的弹头分子研究进展. 中国医药生物技术, 2017, 012(006):549-555. [7]王彦明, 郝伯钧, 钟武, 等. auristatin类抗体药物偶联物研究进展. 国际药学研究杂志, 2015, 42(004):427-438. [8]王彦明. 美登素类抗体药物偶联物研究进展. 国际药学研究杂志, 2016(43):410-419. [9]Wakankar AA,Feeney MB,Rivera J,et al. Physicochemical stability of the antibody- drug conjugate trastuzumab- DM1: changes due to modification and conjugation processes. Bioconjug Chem,2010,21(9):1588-1595. [10] Nakada T, Sugihara K, Jikoh T, et al. The Latest Research and Development into the Antibody-Drug Conjugate, [fam-] Trastuzumab Deruxtecan (DS-8201a), for HER2 Cancer Therapy. Chem Pharm Bull (Tokyo). 2019;67(3):173-185. [11] Xu Z, Guo D, Jiang Z, et al. Novel HER2-Targeting Antibody-Drug Conjugates of Trastuzumab Beyond T-DM1 in Breast Cancer: Trastuzumab Deruxtecan(DS-8201a) and (Vic-)Trastuzumab Duocarmazine (SYD985). Eur J Med Chem. 2019 Dec 1;183:111682. [12]Mitsui I, Kumazawa E, Hirota Y, et al. A new water-soluble camptothecin derivative, DX-8951f, exhibits potent antitumor activity against human tumors in vitro and in vivo. Jpn J Cancer Res. 1995 Aug;86(8):776-82. [13] Ogitani Y, Hagihara K, Oitate M, et al. Bystander killing effect of DS-8201a, a novel anti-human epidermal growth factor receptor 2 antibody-drug conjugate, in tumors with human epidermal growth factor receptor 2 heterogeneity. Cancer Sci. 2016 Jul;107(7):1039-46.